|
| Испарение и конденсация |
Пленочное кипение |
Сверхтекучий гелий |
Эксперименты | События | Библиотека |
Испарение и конденсацияПленочное кипениеСверхтекучий гелийЭксперименты События и мероприятияБиблиотека• История холода• Элементы физической кинетики• Разделение газовых смесей• Методические указания. Анализ криогенных установок• Оборудование гелиевого ожижителя Г-45• Методические указания. К практическим занятиям в криоцентре• Криогенные трубопроводы• Хранение и транпорт ожиженных газов• Основы методики проектирования криогенных установок• Вспомогательное оборудование криогенных установок• Расчет и оптимизация схем криогенных установок• Расчет низкотемпературных установок• Методика расчета схем криогенных установок (рефрижераторы и ожижители)• Методика расчета схем криогенных установок (рефрижераторы с нестационарными потоками)• Характеристики криогенных систем при работе на смесях• Механические свойства твердых тел при низких температурах• Людвиг Больцман. Лекции по теории газовСправочные данные БольцманиадаХейке Камерлинг-ОннесКриогениус |
Бродянский В.М. От твердой воды до жидкого гелия (история холода)Глава пятая КРИОГЕНИКА НЕ ТОЛЬКО ОЖИЖАЕТ ГАЗЫ, НО И РАЗДЕЛЯЕТ ИХ СМЕСИ
Наступило время перехода 5.1. ОТ ИСКУССТВА ПЕРЕГОНКИ К НИЗКОТЕМПЕРАТУРНОЙ РЕКТИФИКАЦИИРезультаты, полученные К. Линде в работах 1894-1896 гг., положили начало еще одному, совершенно новому направлению криогеники - низкотемпературному разделению газовых смесей, в первую очередь воздуха. В статье, опубликованной в английском журнале "Engineer" (1896 г.), К. Линде впервые написал об этом: «При ожижении воздуха физики всегда наблюдали, что обе его составные части (мы будем иметь в виду только азот и кислород) одинаково переходят в жидкое состояние, хотя температура кипения азота намного ниже, чем у кислорода. Однако, с другой стороны, при испарении более летучий азот отделяется сильнее; жидкость по мере испарения все больше обогащается кислородом» [В опытах Линде, описанных в гл. 4, ожиженный воздух содержал до 70% О2 (при концентрации его в атмосферном воздухе 20,8%)]. И далее: "В новом аппарате, где сепарация жидкости происходит непосредственно в воздухе, проходящем через него, наблюдается такое же обогащение жидкости кислородом. Таким образом, становится очевидным, что если поставить целью создать аппарат, в котором будут происходить ожижение и последующее испарение, то задачу разделения можно реализовать, используя охлаждение и ожижение. И кислород, и азот могут быть выведены из машины как газы при обычных температурах, что позволяет оставить (рекуперировать) в аппарате количество холода, которое необходимо для их охлаждения и сжижения". Совершенно очевидно, что в этих строках дается совершенно четкая программа создания нового направления техники - разделения воздуха на кислород и азот новым способом, основанным на его ожижении. К. Линде никогда не ограничивался только констатированием возможности создания чего-либо: он тут же приводит описание первого аппарата для разделения воздуха. Из этого очень простого и еще несовершенного устройства родилась усилиями многих исследователей и изобретателей в дальнейшем целая отрасль промышленности. Она дает теперь сотни миллионов кубометров в год кислорода, азота и многих других продуктов, выделяемых не только из воздуха, но и из природного газа, искусственных газовых смесей, получаемых на промышленных предприятиях и в сельском хозяйстве. К. Линде несколько позже в значительной степени предсказал, опираясь на первые достижения, такое развитие этой области в своей публичной лекции, пророчески им названной "сокровища атмосферы" (Мюнхен, 1907 г.). Он отметил три этапа в отношениях людей с атмосферой. Первый этап составили "тысячелетия, когда люди вместе со всем органическим миром черпали из атмосферы существенные основы своего бытия, не выясняя при этом причины наблюдаемых процессов". Затем шел "охватывающий несколько столетий век ее научного исследования". И вот теперь наступил третий этап, когда "новейшие успешные достижения техники направлены на то, чтобы составные элементы атмосферного воздуха переработать в продукцию народнохозяйственного значения". В целом он, применительно к своей теме, дал четкий обзор того, как, по его словам, "деятельный человек от чувственного восприятия и инстинктивного использования естественных сил перешел к исследованию их свойств и законов, а затем и к их техническому использованию". [Интересно, что здесь Линде в точности следует марксистской теории познания: вспомним знаменитую формулировку В.И. Ленина: "от живого созерцания к абстрактному мышлению, и от него - к практике".] Третий научный комментарий. Чтобы понять ход работ Линде и его последователей по разделению ожиженных газовых смесей при низких температурах, необходимо хотя бы коротко познакомиться с их свойствами. Они, в принципе, ничем не отличаются от тех, которые характерны для газовых смесей при обычных температурах, близких к Тос. Эти свойства определяются законами, которые были открыты и теоретически обоснованы русским физико-химиком академиком Д.П. Коноваловым (1856-1929 гг.), учеником Д.И. Менделеева, в 80-х годах прошлого века. Законы Коновалова устанавливают связь между составами жидкой смеси двух веществ и пара над ней. Для разбора простейшего случая, который нам нужен, достаточно воспользоваться первым (из трех) законом Коновалова, который гласит: "Пар жидкой однородной смеси двух взаиморастворимых веществ (компонентов) относительно богаче тем компонентом, добавление которого понижает температуру кипения смеси при данном давлении". Проанализируем на самом простом примере распространенной (иногда даже слишком распространенной) смеси этилового спирта и воды следствия первого закона Коновалова. Известно, что температура кипения чистого спирта при атмосферном давлении составляет около 80°С, а воды при этих же условиях - 100°С. Следовательно, вода здесь высококипящий компонент, а спирт - низкокипящий. Смесь С2Н5ОН и Н2О кипит при промежуточных температурах; чем больше в ней низко кипящего компонента - спирта, тем температура кипения смеси ниже. Следовательно, именно спирт будет в данном случае тем компонентом, давление которого понижает температуру кипения смеси при данном давлении; по первому закону Коновалова его всегда будет в паре больше, чем в жидкости.
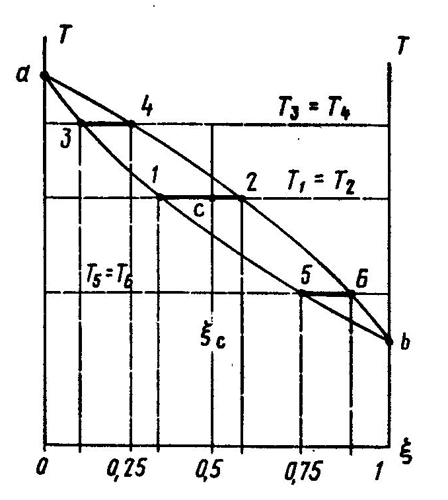
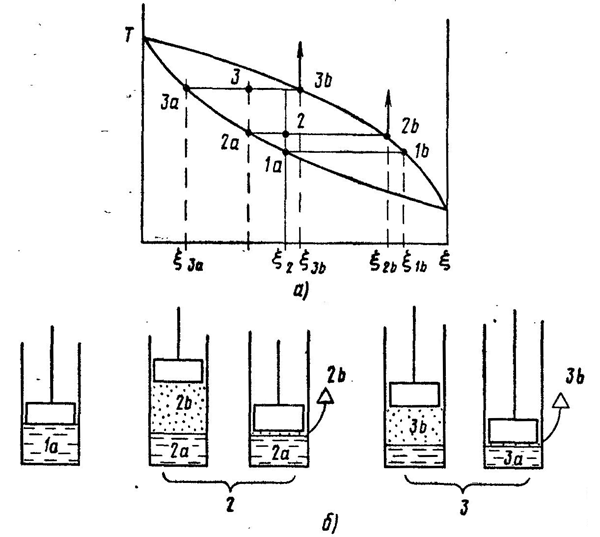
Эту зависимость удобно показать графически (рис. 5.1) на Т, ξ - диаграмме. [Концентрация (объемная или массовая доля) обычно выражается содержанием легкокипящего компонента (в данном случае спирта) в смеси.] Кривые показывают зависимость температуры от концентрации: верхняя - для пара, нижняя - для жидкости. Так как температуры пара и жидкости, из которой он образуется, равны, то по диаграмме легко установить состав пара по составу жидкости (и наоборот), проведя соответствующую горизонтальную линию - изотерму. Так, например, точка 1 соответствует жидкости с содержанием спирта 0,3 (т.е. 30%). Равновесный ей пар имеет температуру и состав, отражаемый положением точки 2; в нем спирта намного больше - около 60%. Аналогичная ситуация будет и при других концентрациях - как меньших (точки 3 и 4), так и больших (точки 5 и 6). Разница только в том, что концентрации пара и жидкости будут различаться меньше; в крайних точках а и b пар и жидкость имеют один состав - в первом случае будут состоять из чистой воды, во втором - из чистого спирта. Т, ? - диаграмма обладает еще одним полезным свойством. Точка с на изотерме, соответствующая парожидкостной смеси, лежащая между кривыми пара и жидкости, делит ее на две части. Отношение длин отрезка, прилегающего к линии жидкости (1с), и отрезка, прилегающего к линии пара (с2), равно отношению количеств пара и жидкости. То, о чем говорилось выше, относится только к стационарному состоянию - равновесию между паром и жидкостью. Но для практических целей важно знать, что будет с жидкостью, если испарить ее значительную часть. Результаты такого процесса тоже можно ясно представить на Т, ξ -диаграмме (рис. 5.2, а). Если жидкость, имеющую состав ξ2 и температуру Т1 (положение 1а, рис. 5.2, б) частично испарить, то общий состав ξ2 системы пар + жидкость (положение 2) не изменится, а температура повысится до Т2. Но теперь система будет состоять из жидкости, менее богатой спиртом (ξ2а) и пара, более богатого им (ξ2b). Если пар отвести, а жидкость снова частично испарить, то аналогичный процесс повторится (точки 3, 3а и 3b). Таким образом, в сосуде после этих операций останется часть жидкости состава ξ3а, состоящая в основном из воды с относительно небольшой примесью спирта. Что касается пара, то его состав по мере испарения тоже будет меняться от ξ1b до ξ2b и ξ3b; концентрация спирта в нем (а следовательно, и в жидкости, которая может быть получена из него) будет тоже уменьшаться.
Следующая страница: Перегонка с дефлегмацией
|
|
Испарение и конденсация
Пленочное кипение
Сверхтекучий гелий
Эксперименты События Библиотека Справочники Больцманиада Камерлинг-Оннес Криогениус |
|
© Криофизика.рф 2006-2021. Молекулярно-кинетическая теория. Научные публикации. Испарение и конденсация. Плёночное кипение. Сверхтекучий гелий. |
о проекте условия использования |
контакты карта сайта |